.jpeg)
Mấy ngày qua, liên tiếp hai thông tin về các bệnh nhân ở London và Hà Lan thành người thứ 2 và 3 trên thế giới được sạch hết virus HIV trong máu sau khi cấy ghép tủy xương từ một người hiến tặng có đột biến gen tổng hợp thụ thể CCR5 làm bất hoạt virus HIV làm “sốt” dư luận.
Thụ thể CCR5 nằm ở đâu? Chức năng là gì? Tại sao đột biến CCR5 lại kháng được sự xâm nhập virus HIV?
Thụ thể CCR5
CCR5, thụ thể chemokine C-C loại 5, còn gọi là CD195, là một protein trên bề mặt các tế bào liên quan đến hệ thống miễn dịch như bạch huyết cầu, lympho T, đại thực bào… và hoạt động như một thụ thể cho chất trung gian kích thích hóa học (chemokine).
Ở người, gene CCR5 mã hóa protein CCR5 nằm ở nhánh ngắn (p) vị trí 21 trên nhiễm sắc thể 3. Một số người đã di truyền đột biến Delta 32, dẫn đến việc xóa một phần gen CCR5. Người mang gen đồng hợp tử của đột biến này kháng với các chủng nhiễm HIV-1 của vùng nhiệt đới.
CCR5 liên kết tác dụng với CCL3, CCL4 (MIP 1α và 1β) và CCL3L1, và tương tác với CCL5 (RANTES).
CCR5 hiện diện chủ yếu trên các tế bào lympho T, đại thực bào, tế bào đuôi gai, bạch cầu ái toan, microglia và một quần thể tế bào ung thư vú hoặc ung thư tuyến tiền liệt. Do đó, các chất ức chế CCR5 ngăn chặn được sự di căn ung thư vú và tuyến tiền liệt. CCR5 đóng vai trò trong đáp ứng viêm nhưng chức năng chưa rõ ràng.
Đặc biệt virus HIV sử dụng CCR5 như một đồng thụ thể để xâm nhập vào tế bào. Do đó, đột biến Delta 32 ở người tạo ra khiếm khuyết di truyền của CCR5 tạo ra các thụ thể không chức năng sẽ ngăn chặn được sự xâm nhập của HIV vào tế bào.
Đột biến CCR5 Delta 32
Đột biến CCR5Delta 32, CCR5-Δ32, CCR5-D32, xảy ra khi mất một cặp base vị trí 32 (32-base-pair deletion) dẫn đến việc tạo ra các thụ thể không có chức năng.
Người dị hợp tử với các thay đổi gene, alen (allele) đột biến sẽ bị giảm hơn 50% số các thụ thể CCR5 chức năng trên bề mặt tế bào do sự giảm dần thụ thể và sự vận chuyển CCR5 bị cản trở. Những người này có khả năng chống nhiễm HIV-1 và chậm phát triển chậm AIDS so với người thường. Sự dị hợp tử của alen đột biến này cũng đã cho thấy cải thiện phản ứng với một số virút như retrovirus.
Ở châu Âu, đột biến alen CCR5 32 có tần số là 10% với dị hợp tử và 1% với đồng hợp tử. Đột biến này rất hiếm ở người châu Phi và châu Á.
Vì virút HIV sử dụng CCR5 như một đồng thụ thể để xâm nhập vào tế bào, nên đột biến Delta 32 ở người sẽ tạo ra các thụ thể không chức năng, vô hình trung đường vào tế bào của HIV bị ngăn chặn.
Đột biến thụ thể CCR5 gây kháng nhiễm HIV
Thụ thể CCR5 có trên các bề mặt các tế bào bạch huyết, đặc biệt là lympho T và đại thực bào, và HIV sử dụng CCR5 như một đồng thụ thể để xâm nhập vào các tế bào miễn dịch.
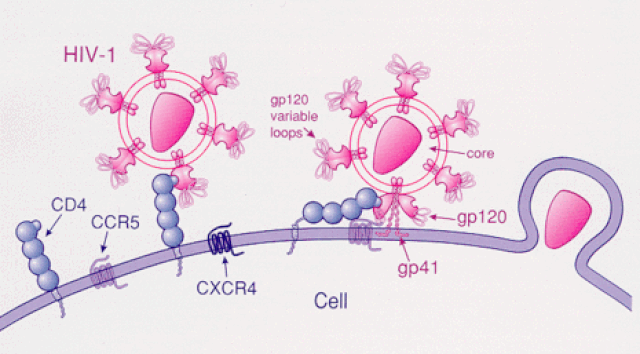
Phải vào trong tế bào, virus HIV mới có thể nhân lên, làm suy yếu hay tiêu diệt các tế bào miễn dịch và gây ra hội chứng Suy giảm miễn dịch mắc phải (acquired immune suppressive syndrome, AIDS), khiến hệ miễn dịch cơ thể yếu dần, không có khả năng chống lại các bệnh lây nhiễm và bệnh nhân sẽ chết.
Do đó, khi thụ thể CCR5 bị sụt giảm hay thiếu hụt các cửa ngõ xâm nhập của virút không còn, con người sẽ miễn nhiễm với HIV.
Lý do khiến ba bệnh nhân ghép tủy hết HIV
Điểm chung của cả ba bệnh nhân hết nhiễm HIV này là đều được ghép tủy để chữa một bệnh ác tính kèm theo. Quy trình điều trị chung gồm hai bước: (1) đầu tiên bệnh nhân được hóa trị hoặc xạ trị để tiêu diệt hết tế bào máu và tủy xương, (2) sau đó bệnh nhân sẽ được ghép tủy là những tế bào tạo máu. Những tế bào máu của người hiến cho sẽ được thay thế cho các tế bào của người nhận.
Vì các tế bào người cho có đột biến alen CCR5, khiến virus HIV không thể nhiễm vào được vì không có thụ thể CCR5 hoạt động. Kết quả là những tế bào máu mới này không bị nhiễm HIV.
Đôi điều bàn luận
Hiện tại, virut HIV không xuyên qua màng các tế bào miễn dịch được khi gene đột biến CCR5 32 xuất hiện được giải thích là do các tế bào này không có thụ thể CCR5, “bàn đạp” để vào trong tế bào. Nhưng cho đến nay, có nhiều nhà khoa học vẫn chưa xác định chắc chắn cơ chế hết lây nhiễm HIV của bệnh nhân. Họ cũng không chắc liệu đột biến CCR5 là lý do chính hay do bệnh “Mảnh ghép chống chủ” (Graft versus Host Disease, GvHD) xảy ra khi truyền máu và ghép tủy, vì cả hai bệnh nhân ở London và Berlin đều bị bênh GvHD này sau ghép tủy; hay có một cơ chế nào khác nữa...
Về lý thuyết, việc khống chế thành công HIV ở ba bệnh nhân ghép tủy đầu tiên này có thể nhân rộng điều trị. Tuy vậy, theo nhiều nhà khoa học, như Giáo sư Ravindra Gupta, Đại học Cambridge, người trực tiếp điều trị cho “bệnh nhân London” rằng phương pháp ghép tủy này khó áp dụng rộng rãi để điều trị HIV vì: Một là quá đắt tiền, không khả thi cho người bình thường; hai là rất khó tìm ra người hiến tủy phù hợp và có đột biến CCR5; ba là trước khi được ghép tủy bệnh nhân phải được hóa, hoặc xạ trị, để tiêu diệt hết các tế bào tạo máu, đây là phương pháp xâm hại, gây suy yếu cơ thể, thậm chí có thể tử vong; và bốn là ghép tủy có thể bị tác dụng không mong muốn là bệnh GvHD. Khoảng 30-60% bệnh nhân gặp GvHD cấp tính và trong số đó có khoảng 15-30% tử vong; và khoảng 50% bệnh nhân bị GvHD mãn tính, phải dùng thuốc điều trị lâu dài, ảnh hưởng chất lượng sống.
Tháng 11/2018, Hạ Kiến Khuê, Thâm Quyến, Quảng Đông, Trung Quốc, công bố nghiên cứu: Cho ra đời cặp song sinh biến đổi gene Nana và Lulu, trong đó gene CCR5 bị vô hiệu hóa giúp cặp song sinh này không bị nhiễm HIV. Nghiên cứu này bị lên án vì vấn đề an toàn và đạo đức, nhiều nhà khoa học lo ngại rằng việc biến đổi gene để miễn nhiễm với HIV cũng có thể tạo ra những nguy cơ bệnh tật khác.
Theo tôi, vì liên hệ đến sinh mạng con người, nên y học bắt buộc phải có bằng chứng (evidence based), và những phương cách điều trị đang còn khảo sát không được áp dụng ngay. Hơn nữa, hiện nay cũng đã có nhiều loại thuốc có thể kiểm soát HIV tốt, giá thành hợp lý, dễ sử dụng, giúp người nhiễm bệnh duy trì cuộc sống khá lâu. Phương pháp ghép tủy chỉ nên áp dụng “ngoại lệ”, đặc thù cho một số ít bệnh nhân nhiễm HIV có kèm theo ung thư.

.jpg?width=300&height=-&type=resize)
.jpg?width=300&height=-&type=resize)
.jpg?width=300&height=-&type=resize)


.jpg?width=300&height=-&type=resize)
.jpg?width=300&height=-&type=resize)

